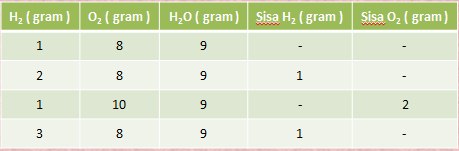
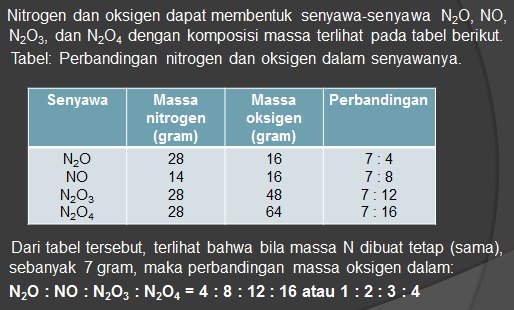
HUKUM PERBANDINGAN VOLUME ( HUKUM GAY LUSSAC ) ----> GAS
” Pada temperatur dan tekanan yang sama, perbandingan volume gas-gas yang bereaksi dan volume gas hasil reaksi merupakan perbandingan bilangan bulat dan sederhana “
- Bila gas A bereaksi dengan gas B membentuk gas AB2, sesuai reaksi :
A (g) + 2 B (g) ----> AB2 (g)
Maka bila reaksi berlangsung pada suhu dan tekanan yang sama,
volume A : volume B : volume AB2 adalah:
1 : 2 : 1
1 liter : 2 liter : 1 liter
5 liter : 10 liter : 5 liter
- Angka 1 : 2 : 1 adalah perbandingan koefisien reaksi 1A (g) + 2 B (g) ----> 1 AB2 (g)
- Angka 1 : 2 : 1 merupakan perbandingan bilangan bulat dan sederhana.
HIPOTESIS AVOGADRO ----> GAS
” gas-gas yang volumenya sama, jika diukur pada temperatur dan tekanan yang sama, mengandung jumlah molekul yang sama pula ”
Avogadro menjelaskan percobaan Gay Lussac dengan menganggap partikel – partikel gas tidak sebagai atom-atom, tetapi sebagai molekul-molekul
A (g) + 2 B (g) ----> AB2 (g)
1 : 2 : 1 (perbandingan koefisien reaksi)
1 liter : 2 liter : 1 liter ( perbandingan volume gas )
5 liter : 10 liter : 5 liter ( perbandingan volume gas )
1 molekul A : 2 molekul B : 1 molekul AB2
5 molekul A : 10 molekul B : 5 molekul AB2
10 molekul A: 20 molekul B : 10 molekul AB2
Bila k = koefisien reaksi
v = volume
n = jumlah molekul, maka
k 1 : k 2 = v 1 : v 2 = n 1 = n 2 atau
k 1 = v 1 = n 1
k2 v2 n 2
Contoh :
10 liter gas nitrogen yang mengandung 5 X 10 23 molekul N2 , bereaksi degan gas hidrogen membentuk gas amonia, sesuai reaksi berikut:
N2 (g) + 3 H2 (g) ----> 2 NH3 (g), bila reaksi berlangsung pada suhu dan tekanan yang sama
a. berapa volume gas H2 yang diperlukan
b. berapa volume gas NH3 yang dihasilkan
c. berapa jumlah molekul NH3 yang dihasilkan
Jawab :
reaksi : N2 (g) + 3 H2 (g) ----> 2 NH3 (g)
1 : 3 : 2 (perbandingan koefisien reaksi )
10 liter : 30 liter : 20 liter (perbandingan volume )
5 X 10 23 : 15 X 10 23 : 10 X 10 23 ( perbandingan molekul/partikel)
a. volume gas H2 yang diperlukan = 30 liter
b. volume gas gas NH3 yang dihasilkan = 20 liter
c. jumlah molekul NH3 yang dihasilkan = 10 X 10 23 molekul.