Hukum-hukum Dasar Kimia
HUKUM KEKEKALAN MASSA ( HUKUM LAVOISIER ).
LAVOISIER menyimpulkan bahwa : jika suatu reaksi kimia dilakukan di ruang tertutup sehingga tidak ada zat-zat yang hilang, maka
massa zat-zat sebelum reaksi dan sesudah reaksi tidak berkurang atau tidak bertambah ( tetap ).
dalam tabung tertutup ditimbang 32 gram belerang dan 63,5 gram tembaga. Setelah dicampur lalu dipanaskan dalam tabung tertutup dan reaksi berjalansempurna maka terjadi zat baru, yaitu tembaga ( II ) sulfida. Berapa massa zat baru tersebut ?
Bunyi Hukum Kekekalan Massa : ” JUMLAH MASSA ZAT-ZAT SEBELUM DAN SESUDAH REAKSI ADALAH SAMA ”
HUKUM PERBANDINGAN TETAP ( HUKUM PROUST )
Bunyi Hukum Perbandingan Tetap :
” DALAM SUATU SENYAWA, PERBANDINGAN MASSA UNSUR-UNSUR PENYUSUNNYA SELALU TETAP ”
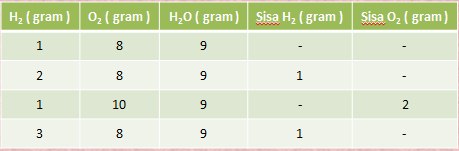
Pada percobaan 1 gram hidrogen dicampur dengan 8 gram oksigen hasilnya ialah 9 gram air. Dan ternyata 8 gram oksigen hanya dapat bereaksi dengan 1 gram hidrogen saja.
Data Percobaan Hidrogen dan Oksigen
contoh soal :
Jika kita mereaksikan 4 gram hidrogen dengan 40 gram oksigen, berapa gram air yang terbentuk?
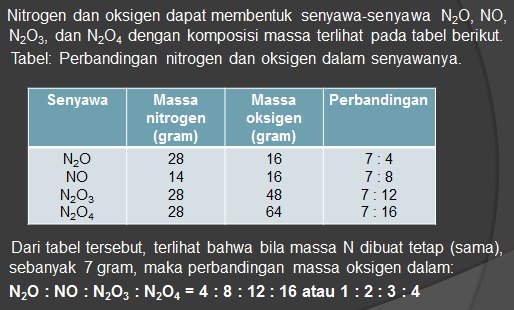
” Bila unsur-unsur dapat membentuk dua macam senyawa atau lebih, dimana massa salah satu unsur tersebut tetap (sama), maka perbandingan massa unsur yang lain dalam senyawa-senyawa tersebut merupakan bilangan bulat dan sederhana ”
HUKUM PERBANDINGAN VOLUME ( HUKUM GAY LUSSAC )
” Pada temperatur dan tekanan yang sama, perbandingan volume gas-gas yang bereaksi dan volume gas hasil reaksi merupakan perbandingan bilangan bulat dan sederhana “
Pada reaksi zat yang wujudnya gas, perbandingan koefisien reaksi ekuivalen dengan perbandingan volume jika reaksi tersebut
dilakukan pada temperatur dan tekanan yang sama.
HIPOTESIS AVOGADRO
” gas-gas yang volumenya sama, jika diukur pada temperatur dan tekanan yang sama, mengandung jumlah molekul yang sama pula ”
Avogadro menjelaskan percobaan Gay Lussac dengan menganggap partikel – partikel gas tidak sebagai atom-atom, tetapi sebagai molekul-molekul
Perbandingan volume gas-gas yang bereaksi dan gas-gas hasil reaksi jika diukur pada temperatur dan tekanan yang sama
akan sesuai dengan perbandingan jumlah molekulnya, akan sama dengan perbandingan koefisien reaksinya
akan sesuai dengan perbandingan jumlah molekulnya, akan sama dengan perbandingan koefisien reaksinya
Contoh Soal :
gas hidrogen direaksikan dengan gas oksigen membentuk 8 liter ( T,P ) uap air. berapa liter gas hidrogen dan gas oksigen dibutuhkan pada reaksi tersebut ?
SOAL HUKUM LAVOISIER
Cotoh Soal 1 :
Dalam wadah tertutup 4 gram logam Natrium dibakar denagn oksigen menghasilkan natrium oksida, jika massa natrium oksida yang dihasilkan adalah 5,6 gram, berapakah massa oksigen yang dibutuhkan ?
Contoh soal 2 :
Pada pembakaran 2,4 gram magnesium di udara dihasilkan 4 gram oksida magnesium, berapa gram oksigen yang terpakai dalam reaksi itu ?
SOAL HUKUM PROUST
Contoh soal 1 :
Pada reaksi antara logam magnesium sebanyak 10 gram dengan 6 gram oksigen sesuai persamaan reaksi :
2 Mg (s) + O2 (g) ——– > 2 MgO (s)
Ternyata dari percobaan dihasilkan 15 gram magnesium oksida dan sisa logam magnesium sebanyak 1 gram, berapakah massa oksigen dan massa Magnesium pada magnesium oksida ? ( Ar Mg = 24, Ar O = 16)
Contoh soal 2 :
Suatu senyawa oksida besi (FeO) memiliki perbandingan massa besi dan oksigen sebesar 7 : 2. Tentukan persen massa dari besi dan oksigen dalam senyawa tersebut.
Contoh Soal 3 :
Perbandingan massa carbon terhadap oksigen dalam karbon dioksida adalah 3 : 8. Berapa gram karbon dioksida dapat dihasilkan apabila 6 gram karbon dengan 16 gram oksigen ?
SOAL HUKUM DALTON
Contoh 1 :
Karbon dapat bergabung denganhidrogen dengan perbandingan 3 : 1 membentuk gas metana berapa massa hidrogen yang diperlukan untuk bereaksi dengan 900 gram C pada metana ?
Contoh 2 :
Unsur A dan unsure B membentuk 2 senyawa yaitu X dan Y. Massa unsure A dalam senyawa X dan Y berturut – turut adalah 46,7 % dan 30,4 %. Tunjukkanlah bahwa hukum Dalton berlaku pada kedua senyawa tersebut ?
HUKUM GAY LUSSAC
Contoh 1 :
Sebanyak 8 L C3H8 dibakar habis dengan oksigen sesuai dengan persamaan reaksi
C3H8 + 5O2 ———- > 3CO2 + 4 H2O pada suhu dan tekanan yang sama volume gas CO2 yang dihasilkan adalah ?
Contoh 2 :
Jika 50 mL gas CxHy dibakar dengan 20 mL oksigen, dihasilkan 150 mL karbon dioksida dan sejumlah uap air. Semua gas diukur pada suhu dan tekanan yang sama. Tentukan rumus CxHy.
Contoh 3 :
Suatu campuran yang terdiri dari metana (CH4) dan etena (C2H4) dibakar sempurna menghasilkan karbon dioksida dan air. Pada suatu percobaan pembakaran 10 mL (T,P) campuran menghasilkan 16 mL (T,P) karbon dioksida. Tentukanlah susunan campuran tersebut.
HUKUM AVOGADRO
Contoh soal 1 :
Sebanyak 35 L gas karbon dioksida mengandung 4,5 x 1023 molekul pada suhu dan tekanan yang sama, tentukan :
- Jumlah molekul 7 L gas hidrogen
- Volume gas amoniak yang mengandung 9 x 1023 molekul







Tidak ada komentar:
Posting Komentar